La deficiencia de CD38 conduce a una respuesta transcriptómica defectuosa de corta duración en un modelo experimental de lupus, que involucra genes relacionados con la señalización purinérgica y con firmas transcriptómicas distintivas asociadas al lupus humano.
Participantes.Mercedes Zubiaur, Laura C. Terrón-Camero, Fernando Gordillo-González, Eduardo Andrés-León, Alicia Barroso-del Jesús, Luz María Canet-Antequera, María M. Pérez Sánchez-Cañete, África Martínez-Blanco, Marilú Domínguez-Pantoja, María Botía-Sánchez, Sonia Pérez-Cabrera, Nerea Bello-Iglesias, Antonio Alcina, Ana-Clara Abadía-Molina, Fuencisla Matesanz, Esther Zumaquero, Ramón Merino, Jaime Sancho.
Relevancia: Frontiers in Immunology. Este trabajo se ha publicado en la revista Frontiers in Immunology, que tiene un Impact Factor: 5.7, según el JCR de 2023 (Web of Science), y un CiteScore: 9.8, según Scopus de 2023. Está en el cuartil Q1 de las revistas de Inmunología.
RESUMEN
Antecedentes: El Lupus Eritematoso Sistémico (LES) es una enfermedad autoinmune que afecta en una mayor proporción a mujeres (90%) que a hombres. En un modelo experimental de LES realizado con ratones hembras, denominado enfermedad crónica de injerto contra huésped (cGVHD, por sus siglas en inglés) hemos demostrado previamente que, en ausencia de CD38 (ratones CD38ko), se desarrolla una enfermedad autoinmune menos severa que en ratones silvestres (WT). En una búsqueda de los mecanismos moleculares que fundamentan esas diferencias, hemos analizado comparativamente los programas transcripcionales de los ratones afectados (CD38ko vs WT) y de ratones sanos no tratados (enfermedad vs controles sanos), a lo largo del tiempo y en dos órganos distintos. De esta forma pretendíamos abordar el desarrollo de la enfermedad de una forma más dinámica (factor tiempo), identificar programas transcripcionales órgano-específicos (células de exudados peritoneales vs bazo), y determinar si había signos moleculares de una resolución más rápida de la enfermedad en los ratones CD38ko, como parecían indicar los resultados previos de nuestro grupo (Front. Immunol. 2021; doi: 10.3389/fimmu.2021.713697).
Métodos: La expresión diferencial de genes (DEGs) se realizó analizando datos de RNA-seq de células de exudados peritoneales (PECs) y de células de bazo de ratones WT y CD38ko, a las dos y cuatro semanas después de la inducción de la enfermedad, y en células de ratones sanos no tratados. El enriquecimiento en grupos y rutas funcionales de los DEGs de las diferentes comparativas se realizó mediante análisis bioinformático de términos de ontología génica relacionados con procesos biológicos (GO-BP) y de rutas KEGG relacionadas con transducción de señales, procesos genéticos, celulares, metabólicos, y biología de sistemas orgánicos. La identidad (fenotipo) de las células fue analizada por citometría de flujo.
Resultados: Los análisis revelaron que en las células peritoneales de los ratones WT había un aumento significativo, y sostenido en el tiempo, de la expresión de un grupo de genes de receptores purinérgicos y ectonucleotidasas. Este grupo de genes mostraban una expresión coordinada con genes estimulados por interferón tipo I (ISGs) y con moléculas clave involucradas en la vía de señalización de la GMP-AMP sintasa cíclica-estimuladora de genes de interferones (cGAS-STING), dos firmas transcriptómicas distintivas en la patología del lupus, en ratones y en humanos. Un segundo perfil transcriptómico de receptores purinérgicos, que incluía P2rx7 y P2rx4, mostró una expresión génica coordinada con los componentes del inflamasoma NLRP3 y sus activadores potenciales. También se evidenció un enriquecimiento distintivo en rutas funcionales relacionadas con inflamación y respuesta inmunitaria, siendo la transcripción de estos procesos mucho menos robusta en los PECs y en células de bazo de CD38ko que de WT.Por último, hemos observado en ratones WT una intensa reprogramación metabólica de genes relacionados con el metabolismo de las mitocondrias (fosforilación oxidativa, termogénesis), con la muerte celular programada (autofagia, piroptosis, apoptosis), y con la respuesta inflamatoria inducida por patrones moleculares asociados a daño mitocondrial (cGAS-STING, inflamasoma NLRP3, senescencia), que indicaba una disfunción mitocondrial más acusada y duradera en ratones WT que en ratones CD38ko.
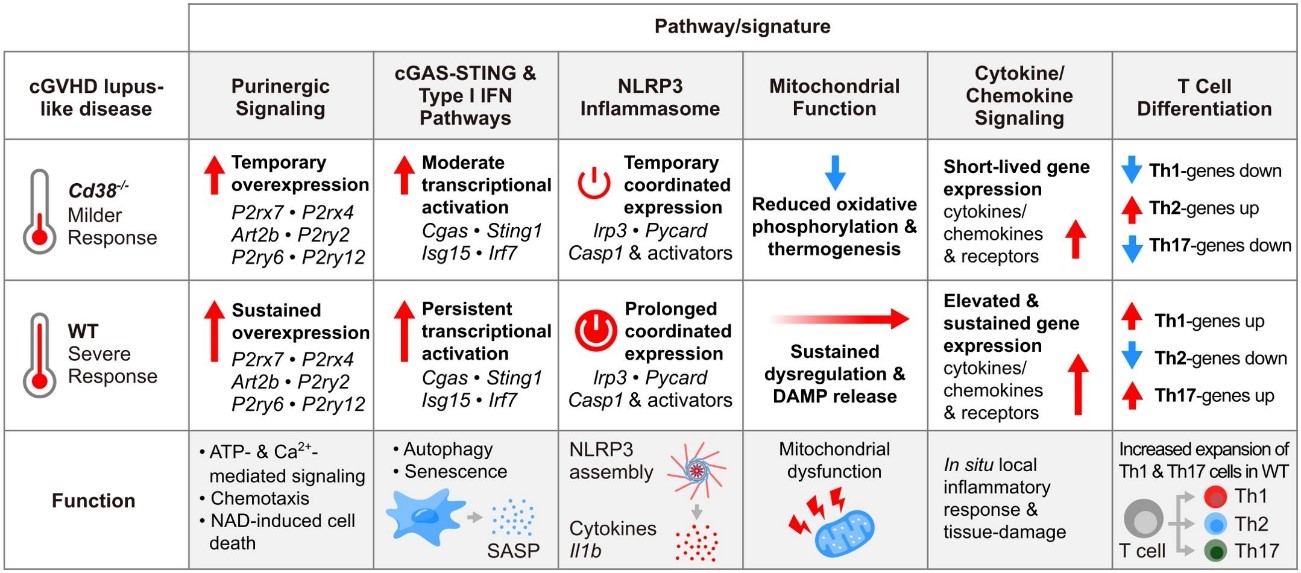
Fig: Resumen de los principales hallazgos de este estudio, y sus funciones asociadas .
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2025.1441981/full
DOI: 10.1016/j.immuni.2024.03.002
